Cục quản lý dược đã thông báo về việc đình chỉ lưu hành và thu hồi thuốc Sebemin dạng viên nén với lý do không đạt tiêu chuẩn chất lượng
đình chỉ lưu hành và thu hồi thuốc Sebemin dạng viên nén
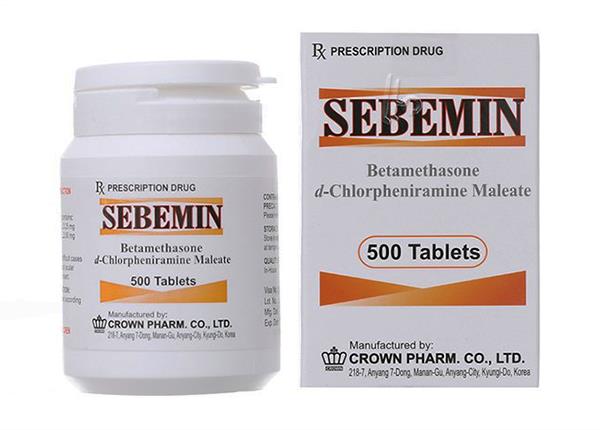
Thuốc Sebemin là thuốc gì?
Thuốc SEBEMIN là thuốc được chỉ định trong các trường hợp:
- Dị ứng đường hô hấp, dị ứng da và mắt, những bệnh viêm mắt cần chỉ định hỗ trợ bằng corticosteroid toàn thân.
- Các trường hợp đặc biệt như sốt cỏ khô trầm trọng (dị ứng phấn hoa), hen phế quản nặng, viêm mũi dị ứng kinh niên, viêm da dị ứng (eczema), viêm da tiếp xúc, các tương tác thuốc và bệnh huyết thanh; các chứng viêm mắt (bao gồm viêm kết mạc dị ứng, viêm giác mạc, viêm mống mắt không hạt, viêm mống mắt-thể mi, viêm màng mạch, viêm màng mạch-võng mạc và viêm màng mạch nho)
Đình chỉ lưu hành và thu hồi thuốc Sebemin dạng viên nén
Theo những thông tin và Trường Cao đẳng Dược Sài Gòn đã cập nhật được, văn bản ngày 26 tháng 2 năm 2019 do cục quản lý dược gửi đến Sở Y tế các tỉnh, thành phố trực thuộc Trung ương và Công ty cổ phần dược liệu Trung ương 2 (PHYTOPHARMA) là công ty nhập khẩu trực tiếp, Cục thông báo:
- Đình chỉ lưu hành toàn quốc thuốc Viên nén SEBEMIN (Betamethason 0,25 mg và d-Chlorpheniramin maleat 2mg), SĐK: VN-14320-11, Số lô: SDM1710, Ngày SX: 24/10/2017, HD: 23/10/2020 do Công ty Crown Pharm.Co., Ltd (Korea) sản xuất, Công ty cổ phần dược liệu Trung ương 2 (PHYTOPHARMA) nhập khẩu

Lý do: thuốc Sebemin bị đình chỉ do thuốc không đạt tiêu chuẩn chỉ tiêu độ đồng đều về hàm lượng và định lượng Betamethasone (chất làm giảm phản ứng phòng vệ tự nhiên của cơ thể và các triệu chứng như sưng tấy và dị ứng).
- Yêu cầu Công ty cổ phần dược liệu Trung ương 2 (PHYTOPHARMA) phải gửi thông báo thu hồi đến các cơ sở bán buôn, bán lẻ, đang sử dụng lô thuốc có thông tin như trên, đồng thời gửi báo cáo thu hồi về cục trong thời hạn 33 ngày.
Cục cũng yếu cầu các sở y tế thành phố trực thuộc trung ương, y tế các ngành thông báo cho các cơ sở kinh doanh thuốc thu hồi lô thuốc không đạt chất lượng nêu trên, kiểm tra, giám sát các đơn vị thực hiện thông báo
Được biết, thuốc Sebemin bị đình chỉ do thuốc không đạt tiêu chuẩn chỉ tiêu độ đồng đều về hàm lượng và định lượng betamethasone (chất làm giảm phản ứng phòng vệ tự nhiên của cơ thể và các triệu chứng như sưng tấy và dị ứng)